* 26번~30번
26. 열용량이 일정한 이상기체의 PV 도표에서 일정 엔트로피 곡선과 일정 온도 곡선에 대한 설명 중 옳은 것은?
① 두 곡선 모두 양(positive)의 기울기를 갖는다.
② 두 곡선 모두 음(negative)의 기울기를 갖는다.
③ 일정 엔트로피 곡선은 음의 기울기를, 일정 온도 곡선은 양의 기울기를 갖는다.
④ 일정 엔트로피 곡선은 양의 기울기를, 일정 온도 곡선은 음의 기울기를 갖는다.
정답 : 2번
----------------------------------------------------------------------------------------------------
카르노 사이클 PV 선도를 떠올리면 쉽게 접근할 수 있다.
카르노 사이클은 등온과정과 단열과정(가역단열이기에 등엔트로피이기도 하다)으로 이루어져 있고,
PV 선도를 보면 모두 기울기가 음수다.
----------------------------------------------------------------------------------------------------
27. 활동도계수(Activity coefficient)에 관한 식으로 옳게 표시된 것은?
(단, \( G^{E} \)는 혼합물 1mol에 대한 과잉깁스에너지이며, $\gamma_{i}$는 i 성분의 활동도계수, n은 전체 몰수, \( n_{i} \)는 i 성분의 몰수, \( n_{j} \)는 i 성분 이외의 몰수를 나타낸다.)
① $\ln \gamma_{i}=\left[\frac{\partial\left(G^{E} / R\right)}{\partial n_{i}}\right]_{T,P,n_{j}}$
② $\ln \gamma_{i}=\left[\frac{\partial\left(nG^{E} / RT\right)}{\partial n_{i}}\right]_{T,n_{j}}$
③ $\ln \gamma_{i}=\left[\frac{\partial\left(nG^{E} / RT\right)}{\partial n_{i}}\right]_{P,n_{j}}$
④ $\ln \gamma_{i}=\left[\frac{\partial\left(nG^{E} / RT\right)}{\partial n_{i}}\right]_{T,P,n_{j}}$
정답 : 4번
----------------------------------------------------------------------------------------------------
일단 용액열역학에 나오는 내용이고, 책들 찾아보면 유도하는 방법이 나와있기도 하고 그런데...
그냥 넘어가야겠다...
활동도계수만 간단히 짚고 넘어가면,
활동도계수는 활동도와 몰분율의 비로 이상적인 혼합물에서 벗어나는 정도를 말한다.
이상적인 혼합물에서 활동도계수는 1이다.
과잉물성 개념도 알아둘 필요는 있는데,
실제용액의 물성값에 대한 이상용액의 물성값의 차이다.
----------------------------------------------------------------------------------------------------
28. 정상상태로 흐르는 유체가 노즐을 통과할 때의 일반적인 에너지 수지식은?
(단, H는 엔탈피, U는 내부에너지, KE는 운동에너지, PE는 위치에너지, Q는 열, W는 일을 나타낸다.)
① ΔH = 0
② ΔH + ΔKE = 0
③ ΔH + ΔPE = 0
④ ΔU = Q - W
정답 : 2번
----------------------------------------------------------------------------------------------------
노즐의 일반적인 특성으로 단열, 일 X, 단일입구-단일출구 등이 있다.
열린계에서 일반적인 에너지수지식으로 시작해서
정상상태를 가정하고, 단일입구-단일출구를 가정해서 정리해나가면
$\Delta H+\frac{\Delta u^{2}}{2}+g \Delta z=Q+W_{s}$
이런 에너지수지식이 나온다.
에너지수지식은 아래식 정도로만 외워두면 충분할 것 같다.

여기서 노즐의 특성을 적용해서 Q, W 날리고,
위치에너지변화 항도 날리면(위치에너지 변화도 미미),
엔탈피변화와 운동에너지변화 항만 남는다.
아래는 15년 2회 에너지수지식(터빈 관련) 계산문제이다.
https://for-freeedom.tistory.com/11
화공기사 2018년 1회 기출 풀이(36번,*37번,38번,39번,40번)
* 합격을 위해 맞춰야할 문제 : 36번, 38번 36. 다음 단위조작 가운데 침출(leaching)에 속하는 것은? ① 소금물 용액에서 소금분리 ② 식초산 - 수용액에서 식초산 회수 ③ 금광석에서 금을 회수
for-freeedom.tistory.com
----------------------------------------------------------------------------------------------------
29. 여름철 실내 온도를 26℃로 유지하기 위해 열펌프의 실내측 방열판의 온도를 5℃, 실외측 방열판의 온도를 18℃로 유지하여야 할 때, 이 열펌프의 성능계수는?
① 21.40
② 19.98
③ 15.56
④ 8.33
정답 : 1번
----------------------------------------------------------------------------------------------------
성능계수 구하라고 하니까 뭐 복잡하게 생각할 것 없이,
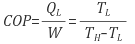
(5+273)/(18-5) = 21.38
----------------------------------------------------------------------------------------------------
30. 가역과정(Reversible process)에 관한 설명 중 틀린 것은?
① 연속적으로 일련의 평형상태들을 거친다.
② 가역과정을 일으키는 계와 외부와의 포텐셜 차는 무한소이다.
③ 폐쇄계에서 부피가 일정한 경우 내부에너지 변화는 온도와 엔트로피변화의 곱이다.
④ 자연상태에서 일어나는 실제 과정이다.
정답 : 4번
----------------------------------------------------------------------------------------------------
1번 : 가역공정은 평형에서 미소한 변화가 연속적으로 일어나는 과정 정도로 얘기할 수 있다.
2번 : 여기서 포텐셜이 화학포텐셜 비슷한 개념이라고 생각하면, 이해가 된다.
(상평형에서 각 상의 화학포텐셜은 같음)
계와 외부가 평형을 이룬상태에서 연속적으로 변화가 일어나는 개념
3번
: dS=dQrev/T 이다. (Qrev=가역과정에서의 Q)
가역과정에서는 ΔS=ΔQ/T 이고, ΔQ=TΔS
열역학1법칙에서 du=dq-dw이고, 일정부피일때 dw=0이므로
du=dq이다.
ΔU=ΔQ=TΔS
4번 : 가역과정은 실제로는 불가능한 이상적인 과정이다.
----------------------------------------------------------------------------------------------------
'화공기사 > 2022년 1회 필기 기출 풀이' 카테고리의 다른 글
| 화공기사 2022년 1회 기출 풀이(46번,47번,48번,49번,50번) (0) | 2022.03.27 |
|---|---|
| 화공기사 2022년 1회 기출 풀이(41번,42번,43번,44번,45번) (0) | 2022.03.27 |
| 화공기사 2022년 1회 기출 풀이(36번,37번,38번,39번,40번) (0) | 2022.03.26 |
| 화공기사 2022년 1회 기출 풀이(31번,32번,33번,34번,35번) (2) | 2022.03.24 |
| 화공기사 2022년 1회 기출 풀이(21번,22번,23번,24번,25번) (2) | 2022.03.15 |


댓글